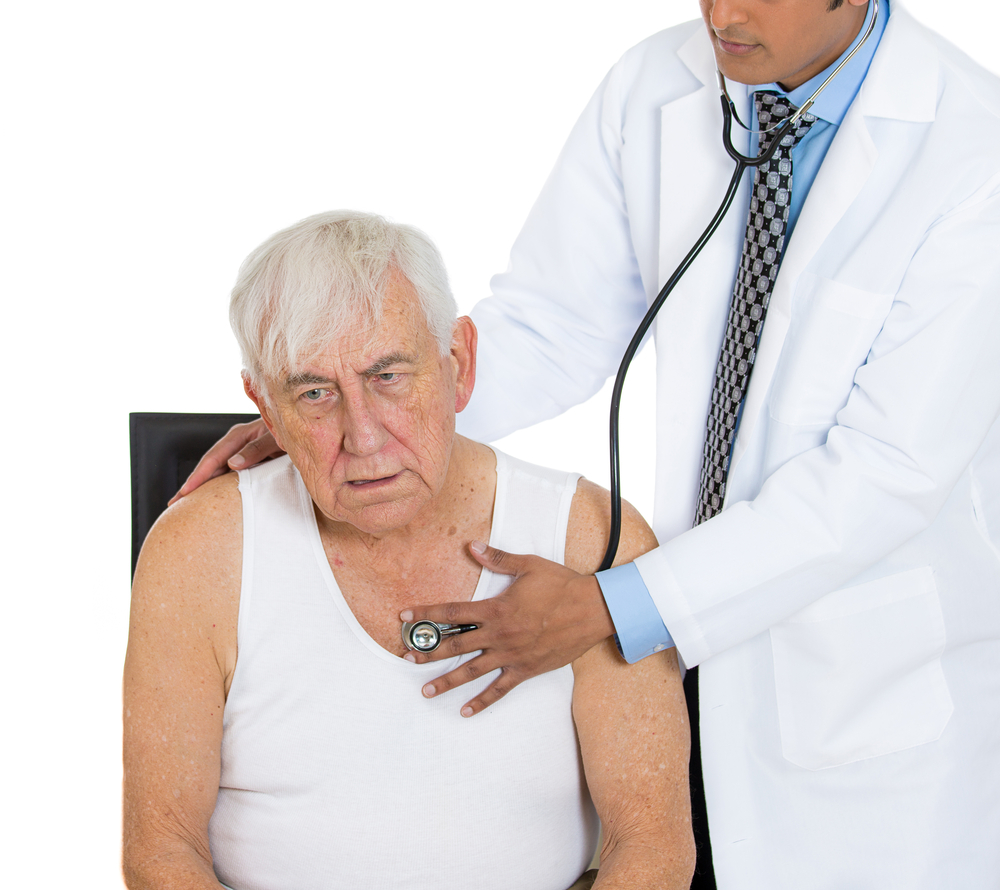
Эндоваскулярное закрытие дефекта межпредсердной перегородки
Содержание:
- Методы диагностики ВПС
- Симптомы и признаки дефекта межпредсердной перегородки
- Аортальный стеноз
- Затронутые группы населения
- Правый желудочек
- Дефект межпредсердной перегородки — лечение в Израиле
- Левое предсердие
- Правое предсердие
- Признаки и симптомы
- Методы исследования
- Особенности кровообращения плода
- Симптомы врожденного порока сердца
- Дефекты межпредсердной перегородки (ДМПП)
- Что такое врожденный порок сердца?
- Клинические исследования
- ООО: открытое овальное окно
Методы диагностики ВПС
Диагностика ВПС основывается на сборе данных анамнеза (наличие пороков развития, в том числе врожденных пороков сердца, генетических заболеваний у ближайших родственников; информация о беременности и наличии этиологических факторов у родителей).
При сборе жалоб обращают внимание на отставание ребенка в развитии, плохую прибавку в весе, плохой аппетит, вялое сосание из груди либо бутылочки, отказ от груди, цианоз, частые респираторные инфекции.
Физикальное обследование
При физикальном обследовании обращают внимание на цвет кожных покровов, определяют пульс и АД (на правой руки и любой ноге), выполняют аускультацию сердца, легких, обращают внимание на наличие периферических отеков, проводят пульсоксиметрию, определяют диурез.
Инструментальная диагностика
Однако, ведущую роль в диагностике и подтверждении, дифференциальной диагностике ВПС играют инструментальные методы обследований: рентгенологическое обследование органов грудной клетки, электрокардиография, эхокардиография, МРТ, КТ, катетеризация полостей сердца.
Чтобы точно продиагностировать заболевание, запишитесь на прием к специалистам сети «Семейный доктор».
Симптомы и признаки дефекта межпредсердной перегородки
Признаки, характерные для пороков сердца, такие как одышка, сердцебиение, быстрая утомляемость при физической нагрузке обычно впервые появляются к третьему году жизни ребенка. Ребенок отстает в физическом развитии, по возможности, уклоняется от занятий физкультурой, часто болеет воспалением легких. Точная картина заболевания и сроки появления жалоб напрямую зависят от размеров дефекта. В легких случаях до появления изменений в состоянии здоровья может пройти несколько десятилетий. Ухудшение состояния пациентов связано с возникающими нарушениями сердечного ритма или развивающейся сердечной недостаточностью.
Аортальный стеноз
Что такое аортальный стеноз?
Аортальный стеноз — это сужение аорты, самого крупного сосуда в нашем организме, который выполняет функцию транспортных путей и несет насыщенную кислородом кровь от сердца ко всем нашим органам и тканям.
Это сужение может встречаться на разных уровнях, и в зависимости от места сужения, различают следующие виды аортального стеноза: клапанный (сужение клапана аорты), надклапанный (собственно самой аорты), подклапанный (сужение, обусловленное чрезмерным разрастанием мышц левого желудочка, препятствующее выходу крови в аорту).
Наиболее часто встречается клапанный стеноз аорты (Рис 1). В норме аортальный клапан позволяет насыщенной кислородом (артериальной) крови свободно поступать из левого желудочка (насос) в аорту, которая несет кровь ко всем органам и тканям нашего организма. Клапан аорты состоит из трех створок. Когда левый желудочек сокращается, створки клапана полностью раскрываются и кровь свободно поступает в аорту; когда левый желудочек расслабляется и наполняется артериальной кровью, притекающей из легких, створки клапана полностью смыкаются и препятствуют обратному току крови из аорты в левый желудочек. При клапанном стенозе створки клапана частично сращены между собой, и их полное открытие становится невозможным.
Естественное течение порока. Или к чему приводит аортальный стеноз?
Аортальный стеноз заставляет левый желудочек работать в режиме сверх усилий, чтобы притолкнуть кровь через сужение в аорту. Постепенно левый желудочек устает работать в таком режиме, что приводит к растяжению его стенки, увеличению полости и развитию сердечной недостаточности.
Клинические проявления аортального стеноза зависят от выраженности сужения. Так, у некоторых новорожденных с очень выраженным (критическим) стенозом, у которых еще до их рождения сердце работало против большого сопротивления, симптоматика явно выраженная. У таких детей частое дыхание и большая частота сердечных сокращений, вялость, отказ от пищи. В самых тяжелых случаях эти пациенты могут нуждаться в искусственной вентиляции легких и лечении в отделении реанимации. Им показано немедленное эндоваскулярное или оперативное лечение. Невыраженные стенозы могут не проявляться. Такие пациенты не нуждаются в лечении. Чаще всего им рекомендуют плановое наблюдение кардиолога и периодическое УЗИ сердца, которое поможет отследить прогрессирование сужения.
Лечение аортального стеноза.
|
Рис 2 – Баллоны для дилятации. Вверху в сложенном состоянии, внизу – в раздутом. |
Выбор операции зависит от места сужения. Так эндоваскулярному лечению подлежат только клапанные аортальные стенозы. Лечение клапанного аортального стеноза начинается в рентген-операционной. Такая операция называется баллонной аортальной вальвулопластикой. Через бедренную артерию в аорту под контролем рентгена вводится тонкая трубочка (катетер), через которую вводится контрастное вещество (Видео 1). Данная манипуляция позволяет определить место и степени сужения. Затем в аорту заводят катетер, на конце которого находится баллон в сложенном состоянии (Рис 2). Когда баллон достигает места сужения, его раздувают, разделяя при этом сращенные между собой створки клапана (Видео 2). Баллон сдувают, а катетер извлекают из тела пациента. С помощью другого катетера проводят измерение давления в левом желудочке и аорте и оценку эффективности процедуры. Длится данная процедура в среднем около одного часа. На теле пациента после такой операции остается только след от прокола бедренной артерии.
Реабилитация после процедуры.
Как правило, пациентов выписывают на следующий день после процедуры. Если стеноз был критическим, ребенок задерживается в клинике дольше. На месте введения катетера в сосуд еще некоторое время должна оставаться стерильная повязка. В течение шести месяцев после процедуры необходимо воздержаться от плановой вакцинации.
|
Видео 1 – Видео из операционной. Контрастное вещество вводиться через диагностический катетер в корень аорты. |
|
Видео 2 – Видео из операционной. Баллон-катетер раздувает зауженный клапан. |
Затронутые группы населения
Дефект межпредсердной перегородки — это редкий врожденный порок сердца, поражающий больше женщин, чем мужчин (2 или 3:1). Приблизительно 1 процент всех детей рождается с врожденным пороком сердца. Около 10 процентов этих детей имеют дефекты межпредсердной перегородки.
Хотя дефекты межпредсердной перегородки можно диагностировать в младенческом возрасте или у детей в возрасте от 6 месяцев до 3 лет, расстройство обычно диагностируется после 40 лет, когда часто и появляются симптомы. Симптомы могут быть замечены в более раннем возрасте, если дефекты являются очень серьезными или если пострадавшие люди живут на большой высоте (например, в горах). Это связано с небольшим сужением артерий сердца и легких на больших высотах.
Первичная форма (тип ostium primum) может встречаться у людей с синдромом Дауна или более чем у 50 процентов людей с синдромом Эллиса ван-Кревельда. Эти дефекты могут также возникать в связи с рядом других расстройств.
Правый желудочек
Функциональная анатомия правого желудочка
Объем правого желудочка у новорожденных составляет 8,5-11 см3,
у детей первого года жизни — 13-20 см3, в 7-9 лет — 28-40 см3,
к 18 годам достигает 150-225 см3. У новорожденных и детей до
1 года длина правого желудочка составляет 4,3-6,2 см, ширина 2,1-3,2
см, у 7-12 летних детей длина желудочка увеличивается до 5-7,2 см,
ширина — до 2-3,5 см. К 18 годам длина правого желудочка достигает
7,3-9,2 см, ширина — 3-5 см. Толщина свободной стенки правого желудочка
у детей до 1 года равна 0,1-0,16 см, к 6 годам она возрастает до 0,2
см, а к 12 годам достигает 0,32 см. Полость правого желудочка имеет
выраженную трабекулярность, при этом основания сосочковых мышц располагаются
в толще трабекул.
Одномерная эхокардиография правого желудочка
Приточный отдел правого желудочка изучают в I стандартной позиции,
отточный в IV позиции. Поперечный размер правого желудочка по данным
эхометрии не соответствует анатомическому поскольку ультразвуковой
луч пересекает полость желудочка в зоне соответствующей 1/3 максимального
поперечного диаметра сферы. Толщина свободной стенки правого желудочка
в одномерном и двухмерном изображении обычно больше, чем анатомическая
из-за выраженной трабекулярности полости. Нормальные значения полости
правого желудочка и толщины его свободной стенки представлены в таблицах
5, 8, 15.
Семиотика правого желудочка
Дилатация правого желудочка
- Идиопатическая дилатация легочной артерии.
- Врожденное отсутствие клапана легочной артерии.
- Частичное отсутствие перикарда.
- Дефект межпредсердной перегородки (первичный, вторичный).
- Аномальный дренаж легочных вен (частичный, тотальный).
- Аномалия Эбштейна (имеется в виду увеличение атриализированной
порции желудочка). - Недостаточность трикуспидального клапана.
- Недостаточность клапана легочной артерии.
- Фистула правой коронарной артерии в правый желудочек.
- Врожденное отсутствие клапана легочной артерии.
- Опухоль правого желудочка.
- Синдром гипоплазии левого желудочка.
- Транспозиция магистральных сосудов.
- Легочная гипертензия (первичная, вторичная).
- Миокардит.
- Застойная сердечная недостаточность.
- Рестриктивная кардиомиопатия.
- Изменение позиции сердца (ротация правого желудочка
кпереди).
Уменьшение полости правого желудочка
- Атрезия трикуспидального клапана.
- Тампонада перикарда.
- Атрезия легочной артерии с интактной межжелудочковой
перегородкой. - Концентрическая гипертрофия правого желудочка.
- Аневризма межжелудочковой перегородки.
- Сдавление правого желудочка объемным образованием
средостения. - Изменение позиции сердца (ротация правого желудочка
кзади).
Гипертрофия свободной стенки правого желудочка
(увеличение толщины стенки более 3 — 5 мм)
- Стеноз легочной артерии (инфундибулярный, клапанный,
надклапанный, стеноз левой или правой ветви легочной артерии). - Легочная гипертензия (первичная, вторичная).
- Рестриктивная кардиомиопатия.
- Опухоль правого желудочка.
- Тетрада Фалло.
- Транспозиция магистральных сосудов.
- У новорожденных, рожденных от матерей,страдающих
диабетом. - Гипертрофическая кардиомиопатия с обструкцией выходного
тракта правого желудочка.
Дополнительные эхосигналы в полости правого желудочка
- Аномальные мышечные пучки.
- Опухоли правого желудочка (чаще рабдомиомы).
- Разрыв аневризмы синуса Вальсальвы в полость правого
желудочка. - Аневризма межжелудочковой перегородки.
- Тромб в правом желудочке.
Двухмерная эхокардиография правого желудочка
Правый желудочек визуализируют во взаимно перпендикулярных осях сканирования:
приточную порцию — в проекции 4-х камер с верхушки и поперечном парастернальном
сечении; отточную — в парастернальной проекции выходного тракта
правого желудочка и поперечном сечении на уровне магистральных сосудов.
Объемная перегрузка правого желудочка
- Дилатация правого желудочка.
- Парадоксальное движение межжелудочковой перегородки
(см) (при наличии легочной гипертензии может не определяться). - Увеличение экскурсии передней створки трикуспидального
клапана. - Систолическое трепетание трикуспидального клапана.
- Уменьшение амплитуды и скорости открытия передней
створки митрального клапана.
Гипертрофия правого желудочка
- Увеличение толщины свободной стенки правого желудочка
более 5 мм. - Гипертрофия (правосторонняя) межжелудочковой перегородки.
- Повышенная трабекулярность полости правого желудочка.
Дефект межпредсердной перегородки — лечение в Израиле
Лечение дефекта межпредсердной перегородки выбирается в зависимости от его размеров и клинической картины заболевания. Если повышение давления в малом (легочном) круге кровообращения сравнительно невелико и у пациента нет существенных жалоб, то операция не обязательна.
В случае, когда незаращение межпредсердной перегородки имеет большой диаметр и оказывает значительное негативное влияние на состояние здоровья больного, ему показана операция.
Хирургическое лечение заключается в ушивании дефекта, что возможно при сравнительно небольших размерах отверстия, не превышающих трех см в диаметре. При наличии отверстия более крупных размеров он устраняется путем наложения заплаты из синтетического материала или, что предпочтительней, из биоматериала. В последнем случае значительно снижается риск образования тромба на месте операции.
Для того чтобы избежать развития воздушной эмболии, перед тем, как окончательно закрыть дефект, выпускают воздух из полости левого желудочка
Для этой цели верхушку сердца осторожно прокалывают большой полой иглой. Разрез на грудной клетке зашивают, оставляя дренаж для оттока раневого содержимого
Результаты операции по устранению дефекта межпредсердной перегородки стабильно хорошие. У пациентов сразу же нормализуется давление в малом круге кровообращения, исчезает одышка, приходят в норму показатели ЭКГ. Размеры сердца уменьшаются, постепенно исчезает гипертрофия его правых отделов. Подавляющее большинство пациентов в дальнейшем чувствуют себя практически здоровыми людьми.
Левое предсердие
Левое предсердие имеет цилиндрическую форму, его объем у новорожденных
составляет 4-5 см3, к концу года достигает 10-14 см3,
к 7-9 годам 24-32 см3, 18-25 годам — 90-135 см3.
Размеры левого предсердия зависят от возраста. У детей до 1 года жизни
переднезадний размер составляет 0,8-1,7 см, у детей до 6 лет — 0,8-2,2
см, до 12 лет — 1,0-2,2 см, до 17 лет — 1,1-2,2 см. Ширина левого
предсердия у детей до 1 года жизни составляет 1-1,17 см, у детей до
6 лет — 1,1-2,1 см, 7-12 лет — 1,3-2,1 см, 13-17 лет — 1,5-2,3
см.
Одномерная эхокардиография левого предсердия
В одномерном режиме проводится визуализация передне-заднего размера
левого предсердия в IV стандартной позиции. В этой позиции ультразвуковой
луч пересекает область левого предсердия, прилежащую к атриовентрикулярному
отверстию.
Семиотика левого предсердия
Увеличение диаметра левого предсердия
- Открытый артериальный проток.
- Дефект межжелудочковой перегородки.
- Недостаточность митрального клапана.
- Стеноз митрального клапана.
- Надклапанное митральное кольцо.
- Рестриктивная кардиомиопатия.
- Гипертрофическая кардиомиопатия.
Уменьшение диаметра левого предсердия
- Синдром гипоплазии левого желудочка.
- Тотальный аномальный дренаж легочных вен.
- Компрессия левого предсердия экстракардиальной опухолью
средостения. - Большой дефект межпредсердной перегородки.
- Миксома левого предсердия.
- Тетрада Фалло.
- Аномалия Эбштейна.
- Двойное отхождение магистральных сосудов от правого
желудочка.
Увеличение экскурсии задней стенки левого предсердия
Связано с увеличением трансмитрального кровотока при различных физиологических
и патологических состояниях.
- Недостаточность митрального клапана.
- Начальные стадии гипертонической болезни.
- Гиперкинетический кардиальный синдром.
- Спортивное сердце.
Дополнительные эхосигналы в полости левого предсердия
- Надклапанное митральное кольцо.
- Тромб левого предсердия.
- Отрыв сухожильных нитей от передней митральной створки.
- Отрыв сухожильных нитей от задней митральной створки.
- Миксома левого предсердия.
- «Болтающийся» митральный клапан (floppy
mitral valve). - Подвижные бактериальные вегетации митрального клапана.
Левое предсердие изучают в нескольких сечениях: парастернальное сечение
длинной оси левого желудочка, в прекции 4-х камер с верхушки и из
эпигастрального доступа
Обращают внимание на форму камеры (в норме
она должна быть овальной), наличие внутриполостных образований, взаимосвязь
с левым желудочком
Правое предсердие
Функциональная анатомия правого предсердия
Правое предсердие имеет цилиндрическую форму; у новорожденных объем
полости составляет 6,5-10 см3, к концу 1 года жизни — 11-18
см3, в 7-9 лет — 22-36 см3, в 18-25 лет — 100-150
см3.
Правое предсердие изучают в двухмерном режиме из проекции 4-х камер
с верхушки или субксифоидально. При субксифоидальном доступе можно
визуализировать место впадения нижней полой вены, а также ее заслонку
(складка эндокарда высотой 5-10 мм) и межвенозный бугорок (на границе
устьев верхней и нижней полой вены). На латеральной стенке правого
предсердия в ряде случаев удается визуализировать мышечный валик (пограничный
гребень ушка правого предсердия). При дилатации ушка могут визуализироваться
гребенчатые мышцы в виде трабекулярных образований, обычно соединяющихся
с устьем полых вен.
Размеры правого предсердия зависят от возраста: у новорожденных и
детей до года переднезадний размер колеблется от 1,1 до 2,1 см, у
детей 1-6 лет — 1,1-2,5 см, у детей 7-12 лет — 1,3-2,5 см, 13-17
лет — 1,4-2,5 см. Ширина предсердия у новорожденных и детей до 1
года от 1,2 до 1,9 см, у детей 1-6 лет — 1,2-2,3 см, у детей 7-12
лет — 1,3-2,3 см, у 13-17-летних — 1,4-2,3 см.
Двухмерная эхокардиография правого предсердия
Правое предсердие визуализируют в нескольких продольных и поперечных
сечениях. Из субкостального доступа определяют место впадения нижней
полой вены в полость камеры (situs solitus). В проекции 4-х камер
из апикального или субкостального доступа устанавливают форму камеры,
наличие в ней дополнительных образований, взаимосвязь с желудочковой
камерой.
Дилатация правого предсердия
- Идиопатическая аневризма правого предсердия.
- Аномальный дренаж легочных вен.
- Дефект межпредсердной перегородки.
- Открытый атриовентрикулярный канал.
- Аномалия Эбштейна.
- Стеноз трикуспидального клапана.
- Недостаточность трикуспидального клапана.
- Опухоль правого предсердия.
- Рестриктивная кардиомиопатия.
- Аритмогенная дисплазия правого желудочка.
- Частичное врожденное отсутствие перикарда.
- Легочное сердце.
- Застойная сердечная недостаточность.
- Констриктивный перикардит.
- Прорыв аневризмы синуса Вальсальвы в правое предсердие.
- Портальная гипертензия.
Уменьшение полости правого предсердия
- Сдавление при опухолях средостения.
- Синдром гипоплазии правого желудочка.
- Большой лево-правый шунт на уровне желудочков (ДМЖП)
или магистральных сосудов (ОАП).
Дополнительные эхосигналы в полости правого предсердия:
- Опухоли правого предсердия (чаще миксомы).
- Заслонка венечного синуса.
- Заслонка нижней полой вены (Евстахиев клапан).
- Заслонка овального отверстия.
- Гребенчатые мышцы ушка правого предсердия.
- Тромб в правом предсердии.
- Пролапс трикуспидального клапана.
- Пролапс клапана нижней полой вены.
- Аневризма межпредсердной перегородки.
Признаки и симптомы
Вторичная форма ДМПП является наиболее распространенной формой этой группы пороков сердца. Средняя часть межпредсердной перегородки в области овального отверстия не закрывается во время развития плода. Размер отверстия может варьироваться, наряду с серьезностью симптомов.
Первичная форма ДМПП встречается реже. Нижняя часть межпредсердной перегородки не может нормально развиваться, оставляя отверстие между предсердиями. Часто клапаны, которые отделяют предсердия от их соответствующих желудочков (трикуспидальный и митральный), также деформированы, и перегородка, которая разделяет желудочки, также может быть дефектной или деформированной (дефект атриовентрикулярной перегородки). Другой дефект (дефект эндокардиальной подушки), возможно, происходит во время эмбрионального развития в ткани, которая формирует перегородку, разделяя сердце на предсердия и желудочки.
Дефект венозного синуса, наименее распространенная форма ДМПП, возникает при наличии отверстия в верхней части межпредсердной перегородки. Этот дефект часто связан с пороками развития вены, которая ведет из легких в сердце (правая легочная вена). Одна из главных вен тела, которая возвращает кровь к сердцу (верхняя полая вена), также может быть повреждена.
У большинства детей с дефектами межпредсердной перегородки симптомы отсутствуют. Несколько пораженных детей могут быть аномально худыми и испытывать умеренные задержки роста, а также повышенную восприимчивость к респираторным инфекциям. Другие дети с очень тяжелым поражением, особенно те, у кого первичная форма дефекта, могут испытывать одышку, легкую утомляемость при физической нагрузке и/или нерегулярное сердцебиение (аритмии).
Шум в сердце является наиболее распространенным признаком и, как правило, единственным признаком ДМПП у детей. Также могут быть изменения в тоне сердца, которые представляют собой закрытие клапанов сердца.
Примерно в возрасте 40 лет люди с ДМПП могут испытывать симптомы, связанные с повышением давления в кровеносных сосудах легких (легочная гипертензия). Повышенное давление в этих сосудах приводит к тому, что кровь движется или «шунтируется» через ненормальное отверстие в сердце. Симптомы могут включать синеватое изменение цвета кожи (цианоз), трещины на кончиках пальцев, непереносимость физических нагрузок и/или ненормальное увеличение количества циркулирующих эритроцитов (полицитемия). Также могут развиваться абсцессы в мозге. Другие симптомы могут включать отек рук и ног и/или затрудненное дыхание.
Тяжелые случаи ДМПП могут привести к опасным для жизни осложнениям, таким как боль в груди, нерегулярное сердцебиение (аритмия), ненормальное расширение сердца, «трепетание» сердца (мерцательная аритмия) и/или сердечная недостаточность. Женщины с дефектами межпредсердной перегородки, которые забеременели, могут подвергаться риску возникновения кровяных сгустков. Эти сгустки (тромбы) могут отделяться от стенок кровеносных сосудов и проходить через системный кровоток, вызывая эмболию.
Методы исследования
Заболевание может быть выявлено на плановом обследовании у кардиолога в первый год жизни ребенка. Если этого не произошло и появились явные симптомы, производится сбор анамнеза, пациент осматривается на предмет оценки цвета кожных покровов, характера дыхания, внутригрудных шумов. Далее требуется аппаратная диагностика, которая проводится следующими способами:
- ЭКГ. Показывает перегрузку в работе правосторонней части органа.
- Рентгенография. Проявляет усиленный легочный рисунок, увеличение легочной артерии и сердечной тени на снимках.
- Рентгеноскопия. Фиксирует усиление пульсации легочных корней, что является специфическим симптомом ДМПП.
- ЭхоКГ. Визуально показывает локализацию просвета, определяет его размеры, а также левосторонний сброс кровяной массы.
- Зондирование сердечных полостей. Фиксирует повышение внутрисердечного давления в правосторонних сегментах.
- МРТ сердца. Наиболее информативная методика, способная предоставить полный объем информации о состоянии сердечно-легочной системы, если остальные диагностические методики не показали эффективности.
Лучшим вариантом исследования при врожденных дефектах строения внутренних органов служит МРТ. Без травмирования и болезненности, которые присущи стандартным эндоскопическим и зондирующим методикам, без повышенного радиационного излучения в противовес рентгену, можно сделать полноценное сканирование в любом возрасте, начиная с первых дней жизни. За один короткий сеанс врачи получат исчерпывающие данные об имеющихся нарушениях, что поможет вовремя приступить к лечению, избежать тяжелых последствия в будущем.
Особенности кровообращения плода

Чтобы было немного проще разобраться в сути того или иного порока сердца, стоит сначала поговорить об особенностях работы системы кровообращения у малыша во время его внутриутробного развития.
- Внутриутробно у малыша легкие не участвуют в насыщении крови кислородом. Весь необходимый кислород ребенок получает от своей мамы по пупочной вене. Роль газообмена у плода выполняет плацента.
- В сердце ребенка нет полностью оксигенированной крови (насыщенной кислородом), так как артериальная кровь, поступившая от мамы, перемешивается с венозной кровью (насыщенной углекислым газом) из печени и нижней половины тела малыша. Этот поток смешанной крови направляется в правое предсердие.
- Насыщенная углекислым газом кровь от верхней половины туловища тоже направляется в правое предсердие, где встречается со смешанной кровью от нижней половины тела.
- Часть более богатой кислородом крови сбрасывается в левое предсердие через овальное окно. Это отверстие, которое открыто у плода и не нужно человеку после его появления на свет.
- У малыша есть еще одно образование, которое ему нужно только во время внутриутробного развития. Это артериальный проток, который является сообщением между аортой и легочной артерией. Для чего он нужен? Так как легкие ребенка внутриутробно в газообмене не участвуют, то и большое их кровоснабжение в это время не нужно. Поэтому 90% крови, которая попадает в легочную артерию из правого желудочка, сбрасывается через этот артериальный проток в нисходящую аорту и кровоснабжает нижнюю половину туловища. Лишь 10% крови из легочной артерии попадает к легким.
- Головной мозг ребенка получает кровь, более насыщенную кислородом, чем остальные органы, так как артерии, кровоснабжающие головной мозг, отходят выше места впадения в аорту артериального протока, по которому течет менее оксигенированная кровь.
- В обоих кругах кровообращения у ребенка внутриутробно разница между содержанием в них кислорода незначительна. Оба круга кровообращения у плода работают параллельно. Поэтому плод очень устойчив ко многим порокам и может нормально развиваться, несмотря на тяжелые сердечные аномалии.
- По мере роста малыша уменьшается кровоснабжение плаценты и увеличивается кровоток во внутренних органах.
Симптомы врожденного порока сердца
Уже в первые недели жизни у малыша появляются симптомы врожденного порока сердца (синюшность носогубного треугольника, одышка, замедленное развитие). Ребенок плохо набирает вес, вялый. Врач может выслушать шум в сердце.
При небольшом размере дефекта громкий систолический шум (возникающий в момент сокращения сердца – систолы) может быть единственным симптомом. В этом случае есть надежда, что отверстие закроется само через несколько месяцев или лет.
Если размеры дефекта велики, требуется хирургическое лечение – операция на открытом сердце. Отверстие может быть таких больших размеров, что хирурги накладывают специальную «заплату». Со временем заплата становится неотличимой, так как обрастает тканью сердца. При некоторых анатомических вариантах возможно закрытие дефекта окклюдером системы «Amplatzer». Операция должна выполняться как можно раньше, чтобы предотвратить осложнения.
Дети с врожденным ДМЖП склонны к развитию воспалительных инфекционных процессов на клапанах сердца – бактериальному эндокардиту.
|
Есть вопросы? Задайте их кардиологу Онлайн. Бесплатно |
Для профилактики эндокардита ребенок должен получать антибиотики, которые рекомендует врач, при простудных заболеваниях или операциях. После успешной хирургической коррекции дефекта через определенное время риск эндокардита значительно снижается и необходимость в антибиотиках отпадает. При полном восстановлении нормального кровообращения прогноз очень хороший, хотя и требуется наблюдение детского кардиолога.
Использованы рисунки врожденных пороков сердца, размещенные на www.childheart.ru.
Дефекты межпредсердной перегородки (ДМПП)
Недоразвитие межпредсердной перегородки может привести к образованию дефекта межпредсердной перегородки (ДМПП) — открытого отверстия между правым и левым предсердиями. В результате этого кровь из левого предсердия под более высоким давлением попадает в правое предсердие и далее в правый желудочек и легкие.
По расположению различают несколько видов дефектов межпредсердной перегородки:
- «Вторичный (центральный) ДМПП» является самым частым и встречается в 80% случаев.
- «Первичный ДМПП» встречается в 15% случаев.
- На остальные формы ДМПП приходится менее 5%.
Диаметр ДМПП варьируется от 3 мм. до 3 см. и более.
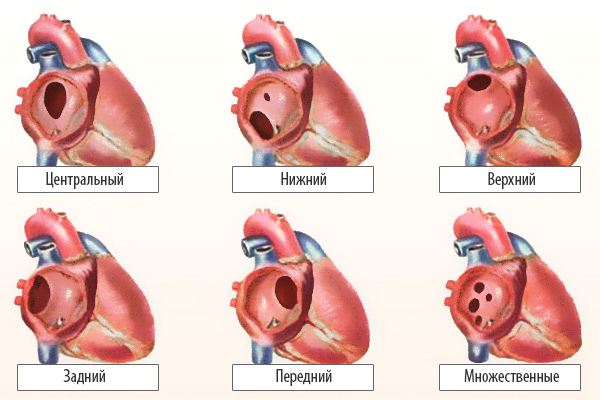 Варианты дефектов межпредсердной перегородки
Варианты дефектов межпредсердной перегородки
80% дефектов у новорожденных закрываются к возрасту 18 месяцев. В 20% случаев дефект сохраняется, при этом показанием к закрытию ДМПП у детей является отверстие более 8 мм., наличие сердечной недостаточности, незаращение дефекта к возрасту 4 лет.
Зачастую дефект межпредсердной пререгородки протекает бессимптомно и не ограничивает жизнь человека на протяжении многих лет, вследствие чего остаётся не диагностированным.
У 70% пациентов не выявленный в детстве ДМПП начинает проявляться в возрасте от 18 до 40 лет.
Проявлениями ДМПП со временем становятся:
- повышенная физическая утомляемость;
- появление одышки при повседневных нагрузках;
- пароксизмы учащенного неритмичного сердцебиения (суправентрикулярная тахикардия, трепетание и фибрилляция предсердий);
- повышенная частота инфекционных заболеваний дыхательной системы;
- отеки нижних конечностей.
Часто пациенты не подозревают о наличии у них ДМПП и диагноз устанавливается неожиданно при плановом выполнении ЭХО-КГ.
Целью закрытия дефекта межпредсердной пререгородки является снижение повышенной нагрузки на сердце и легкие, предотвращение сердечно-легочной недостаточности и последующих необратимых морфологических изменений тканей сердца и лёгких. Чем раньше ДМПП будет устранён, тем выше вероятность полного восстановления морфологии сердца и лёгких, и ниже вероятность развития осложнений из-за длительной их перегрузки.
Наилучшие результаты лечения проявляются при закрытии дефекта у пациентов до 25 лет. Операции проведённые у пациентов старше 40 лет улучшают качество жизни, увеличивают переносимость физических нагрузок, уменьшают проявления одышки. Однако, у данной возрастной группы в результате длительного наличия ДМПП часто развиваются нарушения ритма сердца в результате стойких изменений стенки предсердий: тахикардия, трепетание и фибрилляция предсердий. Таким пациентам после закрытия дефекта необходимо рассмотрение вопроса о выполнении радиочастотной аблации для восстановления нормального сердечного ритма.
Что такое врожденный порок сердца?
Что подразумевается под словами «врожденный порок сердца»? Действительно ли этот диагноз настолько страшен, и ребенок обречен на тяжелые страдания? Врожденными пороками сердца (ВПС) называются аномалии развития сердца, при которых неправильно расположены или имеют различные дефекты основные отделы самого органа или его главные (магистральные) сосуды.
Выделяется очень много разных пороков сердца. Они отличаются и по своим анатомическим особенностям, и по тяжести течения, и по клинической картине, которая развивается у человека. Есть пороки, с которыми человек живет до глубокой старости, занимается спортом, ведет активный образ жизни и даже не подозревает или забывает об их наличии. Некоторые пороки требуют постоянного наблюдения со стороны специалистов, лечения, а иногда и хирургического вмешательства. И наконец, встречаются очень тяжелые аномалии сердца, которые несовместимы с жизнью.
По данным различных исследователей, частота врожденных аномалий сердца колеблется от 2 до 17 на 1000 родившихся малышей. Самым распространенным является дефект перегородки, разделяющей желудочки. Помимо этой аномалии часто встречаются дефект перегородки, разделяющей предсердия, и открытый артериальный проток. Отметим сразу, эти пороки при своевременной диагностике успешно лечатся. Но даже это лечение требуется далеко не всегда, потому что малыш может выздороветь сам без лекарств и оперативного вмешательства.
Клинические исследования
Общие сведения
Известно, что хирургическое устранение дефекта межпредсердной перегородки относится к операциям с низким риском операционной смертности и развития осложнений
В последнее время всё большее внимание уделяется косметическим и эстетическим результатам. Для улучшения эстетических результатов возможно проведение данного вида вмешательства с микрохирургическим доступом через антеролатеральную мини-торакотомию, при которой разрез производится по нижней границе правой молочной железы, с подключением к аппарату искусственного кровообращения (АИК) методом, известным как Port Access
С другой стороны, проведение в раннем возрасте операции по описанному методу, при котором разрез производится под молочной железой, может привести к нарушению развития грудной мышцы и правой молочной железы.
Метод
Нами будут рассмотрены долгосрочные результаты нижеописанного хирургического вмешательства на примере 100 пациенток, страдавших ДМПП, прооперированных в период между 2002 и 2010 гг.
Восемь из них были прооперированы с применением нижней мини-стернотомии, остальные – с применением правосторонней мини-торакотомии. Средний возраст пациенток составлял 12 лет (от 1 до 25 лет), средняя масса тела – 29 кг (от 7 кг до 68 кг). Виды пороков сердца, в связи с которыми проводилось вмешательство: дефект венозного синуса – 19 пациенток, частичный аномальный дренаж легочных вен – 11 пациенток, ДМПП вторичного типа – 70 пациенток.
Нами будут изучены истории болезни и рассмотрены осложнения, связанные с перенесённым хирургическим вмешательством (такие, как необходимость в проведении ревизии, кровотечения, инфекционные осложнения), продолжительность нахождения на искусственной вентиляции лёгких, длительность госпитализации в отделении интенсивной терапии и средняя продолжительность всего периода госпитализации.
Пациентки будут приглашены в клинику для проведения физикального обследования с фотографиями послеоперационных шрамов и фотографиями груди и молочных желёз во фронтальной проекции для оценки симметричности молочных желёз и дефектов стенки грудной клетки. Им будет предложено ответить на вопросы анкеты «Степень удовлетворённости эстетическими результатами операции».
Заключение
Данный вид хирургического вмешательства, широко применяемый во всём мире, обеспечивает хороший лечебный эффект в том, что касается основного заболевания, а также хорошие косметические и эстетические результаты, немаловажные для пациентов женского пола.
ООО: открытое овальное окно

Открытое овальное окно (ООО) – это структура сердца, необходимая на этапе внутриутробного роста ребенка. После появления на свет оно у каждого второго малыша закрывается в норме – к двум неделям. Чем старше, тем остается все меньше детей с ООО, и в большинстве случаев этот дефект сам закрывается к двум годам. Однако не у всех.
ООО не входит в группу пороков сердца, это малая аномалия. Она не имеет ярких клинических признаков (а чаще нет никаких). Обычно его подозревают при шумах над областью сердца при прослушивании. Еще чаще этот диагноз ставят при УЗИ сердца.
Открытое овальное окно не лечат, сама по себе аномалия жизни не мешает. Всем детям с ООО нужно регулярно обследоваться у кардиолога в плановом порядке.